| Accueil / Physique / Bac PRO Physique / Chimie / F.M.B en Chimie | F BINET Mise à jour du 27/11/2005 |
Chimie |
FMB I |
![]()
| Chimie I (Solutions aqueuses) - espèces ioniques en solution - concentration |
- préparation d'une solution de concentration donnée. - réalisation d'un dosage acide-base. - étude qualitative d'une eau: détermination de sa dureté, des concentrations en ions hydrogénocarbonate et chlorure. - choix d'un détergent ou d'un solvant à partir de tests chimiques et de documents techniques. |
+ Le premier TP initiant les élèves à la sécurité et aux manipulations :
tp_bp_fmb_chim_1.doc 207ko
+ Les annexes :
Annexe 1 : Phrases de risques et Conseils de prudence
Annexe 2 : Liste des produits et phrases R/S
Annexe 3 : Pictogramme et lecture d’étiquette
Annexe_1_2_3.doc 515ko
+ Un document de l’Observatoire National de la Sécurité (avec sa bibliographie):
LA PRÉVENTION DU RISQUE CHIMIQUE dans les établissements scolaires
« L'enseignement de la chimie comporte des risques qui, dans la perspective
de garantir la sécurité des élèves et des enseignants, mais aussi dans un souci
pédagogique, doivent être tout à la fois anticipés, compris et maîtrisés :
- anticipés, car la nécessaire mise en œuvre de mesures de prévention suppose,
au préalable, une analyse et une évaluation de ces risques ;
- compris, car de la compréhension de ces risques dépend aussi l'acceptation
et le respect, par les élèves, des consignes de sécurité ;
- maîtrisés, car il appartient à l'équipe pédagogique de garantir la sécurité
des élèves et des personnels exposés.
L'observatoire a souhaité présenter la démarche de prévention des risques et
les mesures d'application au risque chimique, telles que prévues par le code
du travail. Une illustration pratique des principes énoncés doit aider à l'intégration
dans l'enseignement de cette démarche essentielle.
S'agissant d'un document à vocation pratique, les questions liées aux conditions
d'application du code du travail dans les établissements d'enseignement et,
notamment les obligations attachées à l'enseignement de la chimie, ne sont pas
développées ici ; elles font l'objet d'une note qui peut être consultée sur
le site Internet de l'Observatoire. »
ftp://trf.education.gouv.fr/pub/edutel/syst/ons/rapport2000/risque_chimique.pdf
1920ko
Adresse de l’ONS : http://www.education.gouv.fr/syst/ons
+ Un document PowerPoint sur la pesée :
http://mathphylp.scola.ac-paris.fr/documentpedagogique/chimie/Pesée%20powerpoint/pesee.ppt
215ko
+ Un document PowerPoint sur la préparation d’une solution titrée :
http://mathphylp.scola.ac-paris.fr/documentpedagogique/chimie/solution_titree_powerpoint/Préparation%20d'une%20solution%20titrée.ppt
539 ko
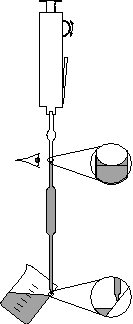
Utilisation de la pipette :
-1- Saisir la pipette par le haut pour l’insérer dans le dispositif de pipetage et éviter ainsi de s’entailler le poignet en cassant la pipette.
-2- Prélever à l’aide du dispositif une quantité suffisante de solution pour rincer la pipette presque horizontale par un mouvement de rotation. Attention à ne pas mettre de solution dans le dispositif de pipetage. Vider la solution dans le récipient de récupération.
-2- Avec la main gauche saisir le bécher incliné et maintenir la pipette contre la paroi avec l’index.
-3- Avec la main droite faire les manipulations d’aspiration en maintenant la pipette parfaitement verticale, le trait de jauge exactement à hauteur d’œil. La pipette est plongée dans la solution à pipeter. On prélève 3-4 cm au dessus du trait de jauge.
-4- On sort la pipette de la solution en la maintenant contre la paroi du bécher. Et on fait descendre régulièrement le liquide jusqu'à ce que le bas du ménisque atteigne le trait de jauge.
-5- En tenant bien le dispositif d’aspiration et le haut de la pipette, changer de bécher.
-6- Vider la pipette en maintenant celle-ci contre la paroi pour réaliser une descente régulière du liquide. Si la pipette comporte deux traits il faut mettre l’œil au niveau du second trait et si elle n’en comporte qu’un seul il ne faut pas chercher à vider l’infime partie restant en bas du tube.
Utilisation de la burette :
-1- Rincer la burette à l’eau distillée puis avec la solution utilisée. On réalisera plusieurs tours de robinet en évitant de le dévisser.
-2- Remplir la burette avec la solution et vider de la solution en ouvrant totalement le robinet pour faire partir la bulle qui se forme sous le robinet.
-3- Remplir la burette à 1cm au dessus du zéro puis vider lentement mais à rythme régulier la solution pour que le bas du ménisque coïncide avec le trait du zéro. L’œil est toujours placé à la hauteur du trait à atteindre.
-4- Remplacer l’erlen de produits usagés par le bécher de la solution à doser.
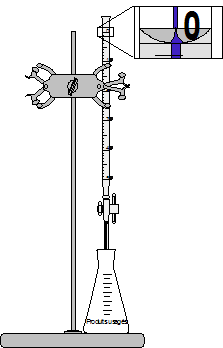
Réalisation d’un dosage :
Le dispositif doit toujours permettre une bonne agitation (agitateur magnétique) sans endommager les dispositifs de mesures (pH-mètre). On réalise généralement dans un premier temps un dosage rapide pour déterminer le volume équivalent correspondant au changement de pH, de couleur, …Puis on réalise un dosage précis en prenant des relevés rapprochés autour du volume équivalent. A l’approche du volume équivalent la précision doit être à la goutte près. Le regard doit être porté principalement sur le dispositif de mesure ou sur la solution à doser.
La solution à doser est généralement diluée avec une quantité d’eau distillée qui n’a pas besoin d’être précise (utilisation de verrerie graduée). Cela permet à l’électrode d’être bien immergée malgré l’agitation.
Rinçage :
Verrerie :
Avant utilisation : -1- Eau distillée. -2- Solution à utiliser.
Après utilisation : -1- Eau du robinet. -2- Eau distillée. (-3-éventuellement solution séchante ou air comprimé)
L’utilisation de papier absorbant ou de chiffons est généralement déconseillée.
Electrodes :
Avant utilisation : -1- Rinçage à l’eau distillée. -2- Séchage délicat avec du papier absorbant.
Après utilisation : -1- Eau distillée. -2- Retour dans le liquide de stockage.
Utilisation d’un bec à gaz :
-1- La pince est fixée sur le haut du tube pour éviter de la brûler.
-2- Le tube est chauffé sur la flamme la plus chaude (bleu plus foncé)
-3- On ne chauffe pas le bas du tube mais la partie haute du liquide car l’ébullition peut être dangereuse et la convection naturelle assure le chauffage de l’ensemble du liquide.
-4- On dirige le tube vers un zone non dangereuse (paroi) et non vers une personne.

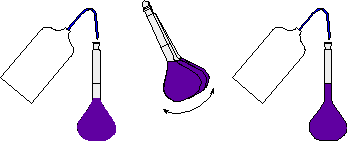
Mise en solution dans la verrerie jaugée :
-1- Pesée d’un solide
-2- Dilution dans la fiole
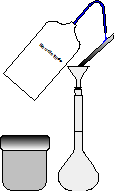
-3- Niveau d’eau parfaitement ajusté au trait de jauge
Sur l'académie de Grenoble au format PDF zippé:
C1.1 Analyse quantitative d'un engrais |
|
C1.2 Dosage de l'acide acétylsalicylique contenu dans un comprimé d'aspirine |
|
C1.3 Vérification de la concentration massique en hydroxyde de sodium d'un déboucheur commercial |
|
C1.4 Détermination de l'acidité d'un lait |
|
C1.5 Dosage des ions chlorure contenus dans une eau minérale |
|
C1.6 Dosage de l'acidité d'un vinaigre |
|
C1.7 Etalonnage d'un pH-mètre |
|
C1.8 Variation du pH d'une solution acide avec sa dilution |
|
C1.9 Détermination de l'acidité totale d'un vin |
|
C1.10 Dosage d'un détartrant de cafetière |
|
C1.11 Détermination de la masse d'acide citrique d'un citron |
|
C1.12 Dosage de l'acide citrique d'une limonade |
|
C1.13 Dosage de l'acide ascorbique contenu dans un comprimé de vitamine C |
AU FORMAT DOC:
● Sujets 2002 et
session de rattrapage :
01 chimie 1 détermination de la
masse d’acide citrique d’un citron
01r chimie 1 dosage de l'acide citrique
d'une limonade
02 chimie 1 analyse qualitative
d’un engrais
● Sujets 2001 et session de
rattrapage :
01 chimie 1 Etalonnage d’un pH-mètre
01r chimie 1 Dosage d’un acide fort.
02 chimie 1 Dosage des ions chlorure
contenu dans une eau minérale.
● Sujets
2000 :
01 chimie 1 Détermination de l’acidité
totale d’un vin.
02 chimie 1 Détermination de l’acidité
d’un lait
● Sujets 1999 :
01 chimie 1 Dosage d’un détartrant
à cafetière.
02 chimie 1 Dosage de l’acide acétylsalicylique
contenu dans un comprimé d’aspirine.
● Sujets
1998 :
12 chimie 1 Variation
du pH d’une solution acide avec sa dilution
13 chimie 1 Vérification
de la concentration massique en hydroxyde de sodium d’un déboucheur commercial
14 chimie 1 Recherche
de quelques ions présents dans une eau minérale
● Sujets
1997 (TP exemples):
02 chimie 1 Concentration d’une
solution. Caractéristique intensité-tension d’un électrolyseur.
07 chimie 1 Détermination du pH
d’une solution d’acide chlorhydrique.
08 chimie 1 Dosage de l’acidité
d’un vinaigre.
09 chimie 1 Préparation d’une solution
d’hydroxyde de sodium.